- By Lucy
- In 醫新觀點
血小板外泌體:為什麼會成為糖尿病足的新藥候選?
作者:安法醫新抗老科學研究中心 研發長 吳杰浩
(歡迎分享與引用,請註明出處:安法醫新抗老科學研究中心,謝謝)
在過去的二十年裡,「細胞治療」一直被視為再生醫學的明星。然而,真正改變臨床病症的力量,有時反而不是細胞本身,而是細胞分泌出的那些微小訊息顆粒——外泌體(exosomes)。
外泌體像是細胞之間傳遞訊息的「飛鴿傳書」,裡面裝著指令與材料,包括蛋白質、脂質、microRNA 等,用來調動組織修復、控制免疫反應,甚至重建血管。
有趣的是,不同來源的細胞,投遞的「指令封包」也不一樣。外泌體就像從不同部門寄出的郵件,有的偏向急救,有的偏向免疫管理,有的偏向長期重塑。這種差異也讓科學家開始想:能不能把外泌體本身做成療法,而不必再把整個細胞輸入體內?
血小板外泌體 vs MSC 外泌體:出身不同,任務也不同
目前討論度最高的兩個來源,是「血小板外泌體」與「間充質幹細胞(MSC)外泌體」。
兩者最大的差異,反而不是技術,而是「生理角色」。
血小板的任務,原本就是「止血、結痂、促進傷口癒合」。從進化角度來看,它們是人體面對創傷時最先抵達的修復部隊。血小板釋放的外泌體帶著大量促血管生成、促纖維重建與降發炎的訊號。這樣的特性,讓它們特別適合慢性傷口,例如糖尿病足潰瘍~一種全球每年導致數百萬患者截肢的疾病。
MSC 外泌體的角色比較不同,它們並不是「前線修復部隊」,而是臨床上用來調節免疫、減少慢性發炎、保護神經與心臟、改善代謝的長期系統性調節者。因此目前全球的臨床試驗分佈也很明顯:MSC 外泌體多為難治性免疫皮膚病、心血管疾病、神經退行性疾病與自體免疫相關領域。而血小板外泌體則集中在「難癒合傷口與組織修復」,以糖尿病足作為核心突破口。
美國真正把「血小板外泌體」當成新藥做的公司
外泌體曾被商業市場包裝成「美容與抗老」的話題,但真正踏入 FDA 新藥開發路線的公司並不多。血小板外泌體的領先者,是從 Mayo Clinic 衍生出去的團隊,後來成立 INTENT Biologics,專門負責臨床二期、三期與未來上市後的商業化。它們的核心產品 PEP Biologic(Purified Exosome Product)從一開始就不是民間美容材料,而是被定位為「藥物製劑」。
值得注意的是,INTENT 並不是單打獨鬥。它與全球最大的細胞製造 CDMO 之一 Lonza 建立合作,由 Lonza 提供後期開發與 GMP 放大能力。這件事的意義在於:外泌體第一次真正踏上「藥廠規模」的 CMC 舞台。
PEP 為什麼得到 FDA 的 Fast Track(快速通道資格)?
比起學術,監管機構的動作往往能看出技術成熟度。
2026 年,FDA 正式給予 PEP 用於糖尿病足的 Fast Track designation。
Fast Track 並不是把藥變快,而是讓藥可以:
- 更早與 FDA 對話
- 更快提交滾動式審查資料
- 在條件允許下縮短上市前時間
能拿到這個資格的生物製劑,通常具備三種特徵:
- 符合重大未被滿足醫療需求
- 有合理機制
- 有初步臨床或動物證據支撐
糖尿病足是典型難題,全球已有數十年沒有真正的結構性突破。PEP 之所以被認為有潛力,除了生物學機制外,也因為它不是「單純塗在傷口上就等傷口自己癒合」,而是採用一種特殊的局部遞送方式。
TISSEEL + 外泌體:把修復訊號留在創面傷口上
醫學界早就知道,如果能讓修復訊號一直待在傷口,而不是被血水或滲出液沖掉,癒合速度會完全不同。
Mayo 團隊將 PEP 做成可室溫保存的凍乾劑型,使用前復溶後與 FDA 核准的纖維蛋白膠 TISSEEL 混合。TISSEEL 就像形成一層人工血塊,把外泌體固定在創面,隨著纖維網慢慢降解,外泌體也隨之釋放。臨床醫師把它稱作「生物凝膠」。
在缺血性傷口的動物模型中,這種遞送方式加速了血管新生、膠原重建,甚至有研究顯示毛囊的再生。(圖一)
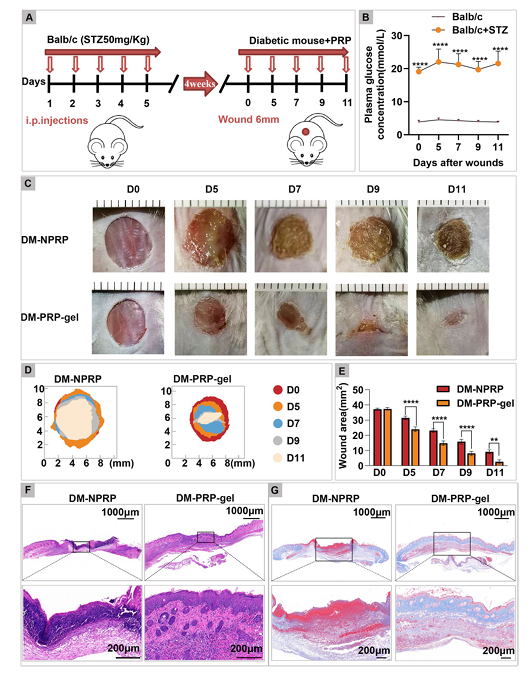
圖一:血小板外泌體能明顯縮小糖尿病潰瘍面積、加速癒合
圖片來源:Ling He et al., Clinical and Experimental Medicine (2025) 25:163
這也是 PEP 在 Phase 2 試驗中最值得觀察的部分:
既不是單純的外用藥膏,也不是侵入性的細胞輸入,而是一種介於生物製劑與醫材之間的結構。
MSC 外泌體仍有巨大舞台,只是方向不同
MSC 外泌體沒有輸給血小板外泌體,只是往不同的疾病方向前進。
目前全世界最活躍的 MSC 外泌體臨床試驗,集中在:
- 難治性皮膚病(如 DEB)
- 免疫介導疾病
- 心肌與血管修復
- 神經退行性疾病
- 自體免疫
- 代謝疾病
這些疾病不僅與慢性發炎有關,也需要系統性的免疫調節。
MSC 外泌體的 RNA cargo 恰好可以扮演這個角色。(圖二)
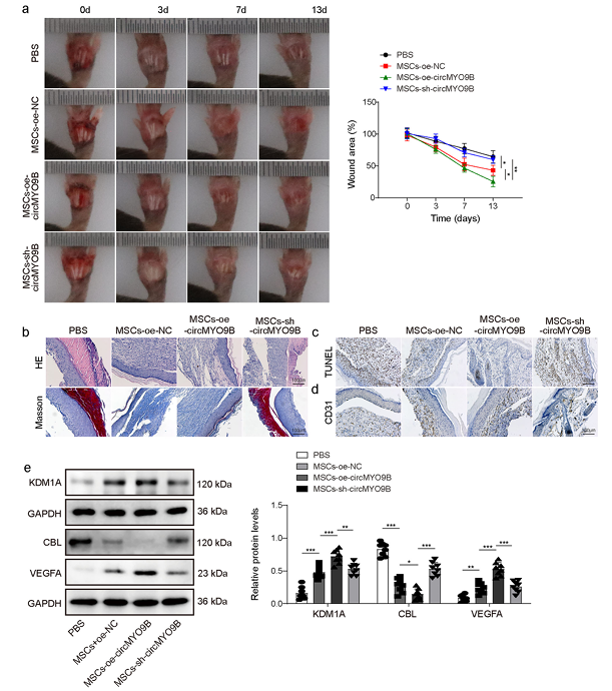
圖二: MSC 外泌體可以透過 RNA cargo(circMYO9B)進入血管內皮細胞並啟動 VEGFA,帶動血管新生。
圖片來源: Zheng Wang et al., Communications Biology (2024) 7:1700
因此如果說血小板外泌體像是「前線工程部隊」,
MSC 外泌體更像是「中央調控總部」。(圖三)
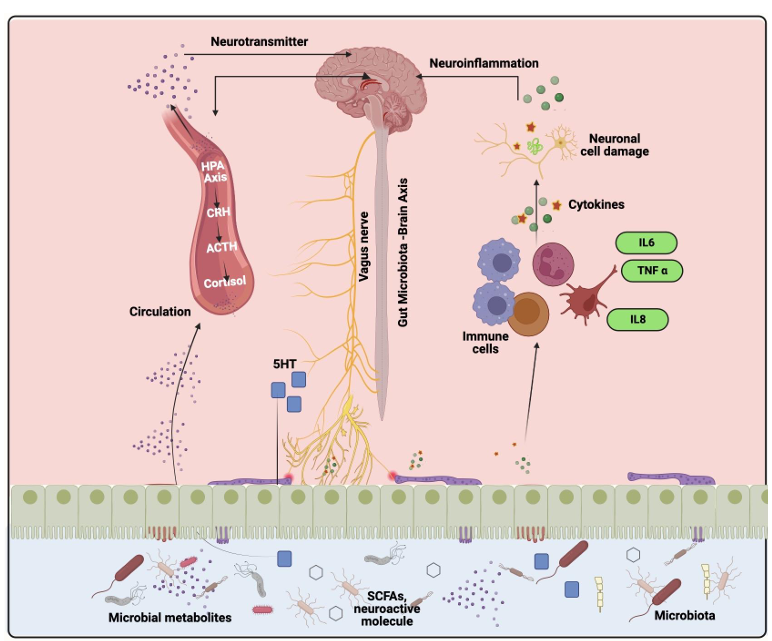
圖三:MSC 外泌體不是單點修補,而是用多階段調控方式縮短炎症期、促血管生成、促上皮化與 ECM 重建,屬微環境調控。
圖片來源:Jialian Yi et al., Diabetes, Metabolic Syndrome and Obesity 2025:18 2955–2976
產業與監管視角下的另一個差異
研究領域常問的是:哪個比較強?
但監管領域問的永遠是:哪個比較“可以做成藥”?
血小板外泌體之所以先走入 Phase 2 的原因之一,在於血小板本身已是高度標準化的血液製品,供應鏈、篩檢流程、病毒清除與製程文件都已有成熟系統。CMC(製程+品質控制)能比較快進入藥廠語言。
MSC 外泌體也能做到,但它需要的是一整套細胞庫系統、生物反應器、RNA cargo 質控以及臨床前驗證。兩條路都成立,但節奏不同。
最後要回答的一個問題:科學界期待什麼?
科學界關注的並不是「自然界是否有外泌體」,而是:
能不能做成藥?能不能量產?能不能一致?能不能合法上市?
血小板外泌體之所以值得看,是因為它讓人第一次看到外泌體走進真正的藥物工業體系,而不是停留在概念或美容市場。
MSC 外泌體則在另一邊默默鋪路,它有更大的長期疾病市場,也有更難的免疫調控課題。兩者最終很可能不是競爭,而是並行。
未來如果糖尿病足 Phase 2/3 成功,加上 Fast Track 提速,我們可能會看到第一個正式以外泌體為主體的生物製劑上市。那將會是再生醫學的又一次轉向——從細胞,走向臨床新藥使用。
參考文獻:
- Platelet‑rich plasma‑derived exosomes accelerate the healing of diabetic foot ulcers by promoting macrophage polarization toward the M2 phenotype. Ling He et al., Clinical and Experimental Medicine (2025) 25:163
- Exosomes in Diabetic Wound Healing: Mechanisms, Applications, and Perspectives. Jianlian Yi et al., Diabetes, Metabolic Syndrome and Obesity (2025):18 2955–2976
- MSC-derived exosomal circMYO9B accelerates diabetic wound healing by promoting angiogenesis through the hnRNPU/CBL/KDM1A/VEGF Aaxis. Zheng Wang et al., Communications Biology (2024) 7:1700