作者: 安法醫新抗老科學研究中心 研發主任 吳宗儒博士Eric
(歡迎分享與引用,請註明出處:#安法醫新抗老科學研究中心,謝謝)
一、糞菌移植基本介紹
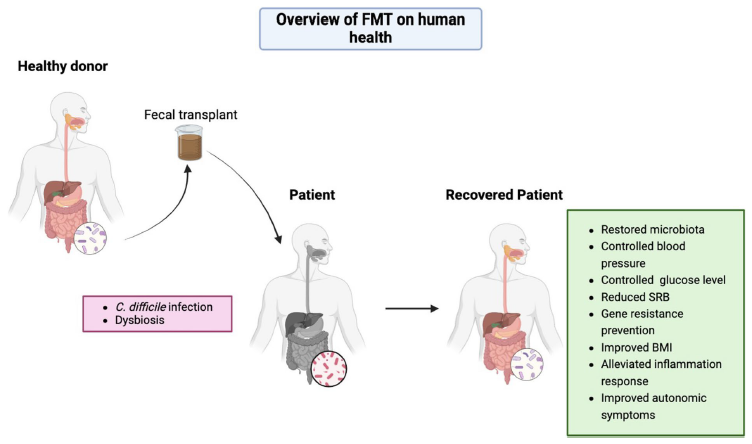
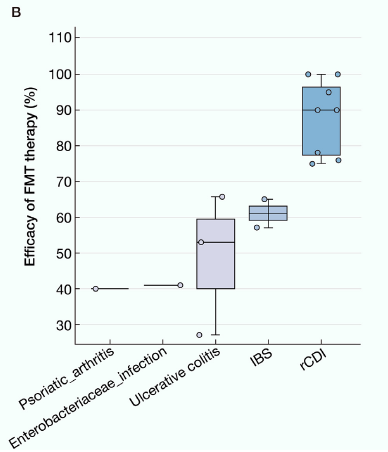
糞菌移植(Fecal Microbiota Transplantation, FMT)顧名思義是指將健康捐贈者的糞便微生物群,經過標準處理後,移植至患者(受贈者)腸道內,以「調整」及「重建」腸道菌群生態系統的治療技術。其實FMT在古醫書中早早被記載,當時被稱為“黃龍湯”即有通便、傷寒解熱之用,迄今現代醫學對FMT的研究則開始有新的認知面貌,特別是在治療胃腸道疾病方面顯示出顯著療效。目前依據各國法規以及特定的適應症,接受FMT治療對於反覆型艱難梭狀芽孢桿菌感染 (recurrent Clostridium difficile infection)的療效最為確立,治癒率可高達 85% 以上,甚至僅需一次治療即能奏效。此外,臨床應用也逐步拓展至發炎行腸病、自閉症、代謝症候群等領域。然而,儘管潛力巨大,FMT 的實施涉及微生物安全、捐贈者及患者篩選與法規認定等多項挑戰,因此需要更深入的研究與跨領域合作以確保其臨床可行性與安全性。
二、糞菌移植流程
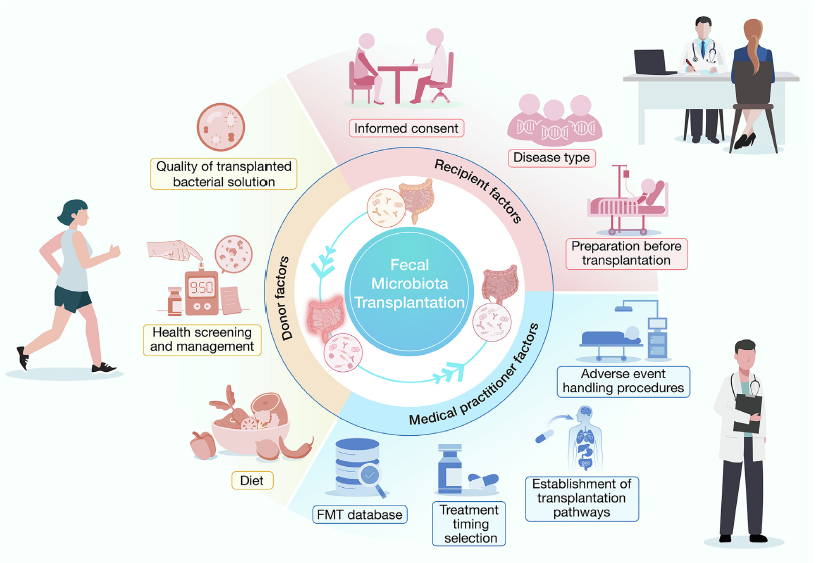
由於FMT屬於專業的醫療型行為,其過程需經過相當縝密的人員篩選、流程建立、標準作業流程以及最後的療效追蹤紀錄,由於FMT技術目前是依各國所屬主管機關所建立的法規下執行(如2021年版,由上海衛健委所公告的上海市菌群移植技術管理規範),以下的四大項目為執行FMT治療需審慎考量面向:
- 捐贈者及患者(受贈者)篩選
糞菌移植的成功與否,在很大程度上取決於糞便捐贈者的品質與受贈者的狀況。為確保安全與療效,現行臨床規範對捐贈者設有極為嚴格的篩選程序。目前各國執行FMT技術的臨床指引共識,理想的捐贈者在年齡、生理健康狀況、心理狀態、家族及個人病史、實驗室檢驗、用藥紀錄、與受贈者間關係、基因圖譜及遺傳性分析均需嚴格篩選,如美國糞便銀行機構OpenBiome更實施多重篩查週期,確保長期追蹤與重複採樣的一致性。
而針對患者而言,除了與健康捐贈者相同進行評估外,對於疾病適應症可優先考量目前治療效果較為顯著的艱難梭狀芽孢桿菌感染、發炎性腸道疾病、大腸激躁症等相關腸道型疾病。但對於免疫抑制患者、移植後患者或重症感染者,需審慎考量移植來源與潛在風險。許多研究發現菌相相容性(microbiota compatibility)可能是影響FMT效果成敗關鍵,因此也許多研究也針對如何將糞便微生物進行「個人化配對」,以提升治療成功率。
- 糞菌備置
糞菌移植的核心,不僅在於捐贈者與受贈者的配對,更關鍵的是對腸菌微生物的標準化處理。從糞便收集、處理、儲存到輸送,每一步都需遵循嚴格流程,同時在製劑的流程規範更需要符合在優良製造規範(Good Manufacturing Practices,GMP),以確保微生物多樣性與生物安全性。目前FMT處理程序可分為以下幾個步驟:
(1) 樣本收集:需在專責設施或醫療機構收集樣本並盡速處理避免微生物降解。
(2) 稀釋與均質攪散:以生理食鹽水或甘油液將糞便均勻混合,確保均勻分佈。
(3) 過濾與離心:透過濾網去除固體顆粒,再進一步濃縮或純化菌液。
(4) 初步定量、分裝並儲存:為確保菌液的穩定性,可先將菌液稀釋後作簡易定量,同時等劑量的方式分裝填充,其一可直接將菌液分裝至袋中或膠囊中,亦或可直接將菌液冷凍乾燥成菌粉後,直接填充至膠囊中。最後可採冷藏或冷凍方式儲存,以保存微生物活性。
- 治療方式
依照法規規定,執行糞菌移植時需在核可醫療機關,並在取得相關操作證照的有專科醫師操作下執行。而目前輸送與給藥方式,包括:結腸鏡下輸入、鼻胃管、灌腸或口服冷凍膠囊(如Rebyota, Vowst等)。
- 後續追蹤及記錄
由於FMT治療在各國仍然是在人體試驗階段及特定疾病條件下所能接受的治療方案,因此患者接受FMT治療後,仍需密切的追蹤療效及是否引發後續不良反應,不僅在生理方面的監控,同時也必須考量心理層面因素。另外也需在針對療效上是否需要增減劑量、頻率也是在整個後續追蹤上需要被調整的關鍵。
三、糞菌移植的挑戰
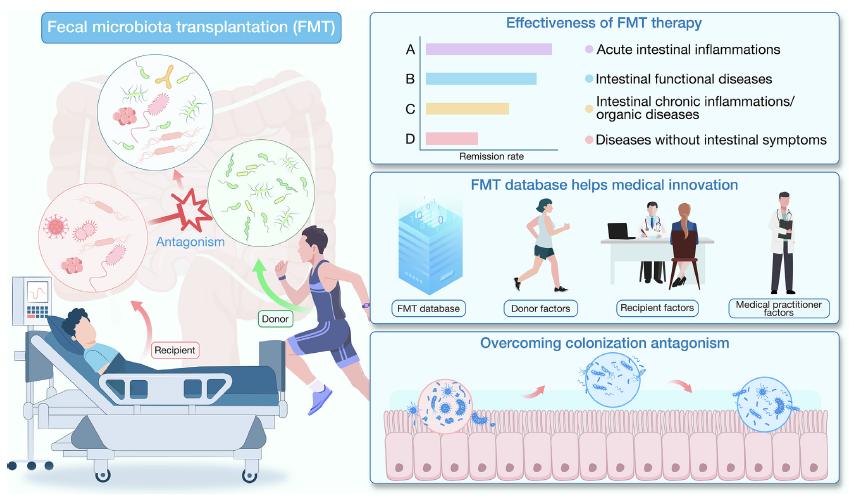
糞菌移植(FMT)已從早期的替代性療法,逐步躍升為現代微生物醫學中具潛力的核心治療手段。其在艱難梭菌感染治療中的卓越療效不僅獲得臨床肯定,更開啟了針對多種腸道與腸外疾病的新療法之路。但對於這樣令人期待的治療方案,我們仍需要保持更客觀及嚴謹審視的角度,如:
- 安全性考量
- 糞便中的微生物包羅萬象,不僅存有細菌,另外還含有古菌、真菌、病毒等,具有高度生物多樣性,不同批次間微生物組成差異大,同時無法在菌液的備製過程中,完整的去除不利於人體健康的微生物,也因此間接也增加了患者日後罹病的風險。
- 細菌的基因片段可能透過轉殖的方式,將細菌的片段基因殖入到人體細胞的染色體中,可能會因此衍生出抗藥性、抗生素抗性或是引發致癌風險。
- 影響既有藥物的有效性
- 因為外來糞菌的殖入導致原本患者菌相的改變,由於部分藥物在體內代謝過程中,需要一部份的腸道菌群的參與,因為糞菌移植後可能會影響既有藥物的代謝及療效
- 由於糞菌移植後無法一一掌控每一株細菌株的功能及代謝,因此可能會與原本療程中藥物產生拮抗
- 法規的限制
- 控管的所屬機關
- 如何評估健康人(又稱為Super donor))及健康糞菌
- 糞菌備置的標準作業流程
- 劑型、劑量及治療方式
- 不良反應控管
四、糞菌移植於臨床上的觀點
糞菌移植的發展雖然仍面臨多重挑戰,包括捐贈者與受贈者的安全性篩選、處理流程的標準化、法規不一致、菌種穩定性問題、倫理爭議與社會接受度等。尤其在商業產品開發階段,如何確保批次穩定性與療效一致,是推動FMT走向主流醫療市場的關鍵門檻。現今備正式核可使用的產品,如美國於2022年批准Rebyota作為首個FMT療法以及2023年核准的批准口服膠囊型產品Vowst,以及在歐盟與澳洲國內則設立專屬的糞菌儲存銀行,僅供組織製劑開發並侷限在臨床人體試驗階段。但在其他國家境內,目前仍處於開發階段及人體臨床試驗中,尚無核可可供人體治療使用的產品。因此針對特定疾病的患者,如需接受糞菌移植療法,請審慎評估並與專科醫師討論,經由合法合規的機構單位來提供完善的療程及服務才能有利於患者疾病的改善。
參考文獻:
- Cao Z, Gao T, Bajinka O, Zhang Y, Yuan X. Fecal microbiota transplantation-current perspective on human health. Front Med (Lausanne). 2025 Mar 14;12:1523870.
- Liu Y, Li X, Chen Y, Yao Q, Zhou J, Wang X, Meng Q, Ji J, Yu Z, Chen X. Fecal microbiota transplantation: application scenarios, efficacy prediction, and factors impacting donor-recipient interplay. Front Microbiol. 2025 Mar 25;16:1556827.
- Hongliang Tian, Xinjun Wang, Zhixun Fang, Long Li, Chunyan Wu, Dexi Bi, Ning Li, Qiyi Chen, Huanlong Qin, Fecal microbiota transplantation in clinical practice: Present controversies and future prospects, hLife, Volume 2, Issue 6, 2024, Pages 269-283.
- Winston, Jenessa A. et al., Clinical Guidelines for Fecal Microbiota Transplantation in Companion Animals. Advances in Small Animal Care, Volume 5, Issue 1, 79 – 107 (2024)
- Peery AF, Kelly CR, Kao D, Vaughn BP, Lebwohl B, Singh S, Imdad A, Altayar O; AGA Clinical Guidelines Committee. Electronic address: Email住址會使用灌水程式保護機制。你需要啟動Javascript才能觀看它. AGA Clinical Practice Guideline on Fecal Microbiota-Based Therapies for Select Gastrointestinal Diseases. Gastroenterology. 2024 Mar;166(3):409-434.
圖片參考: